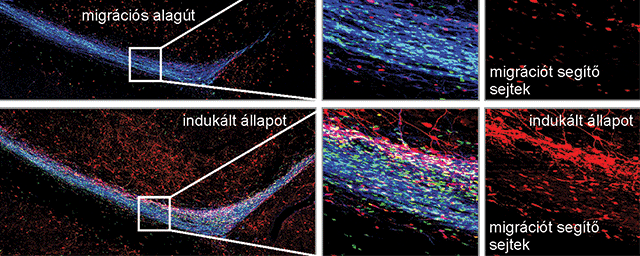
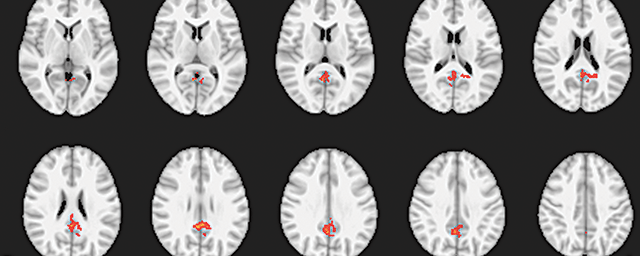
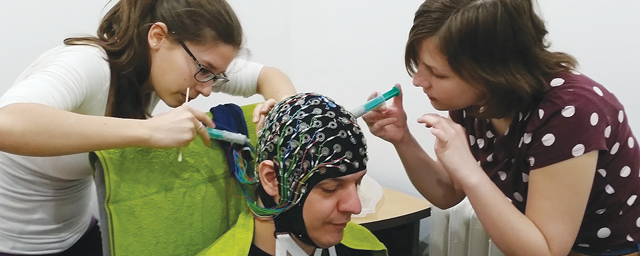
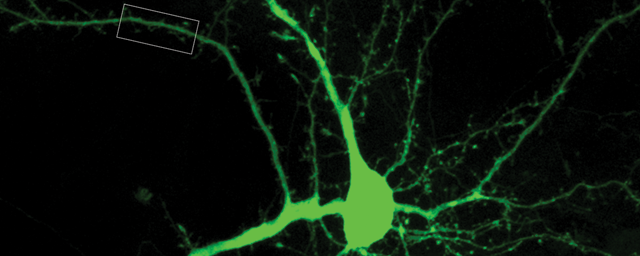
Szűrni, értékelni a célpontokat
„Projektünk kissé kakukktojás a többi alapkutatási program között, mert sarkítva azt mondom, mi nem akarunk felfedezni semmit. Egy olyan eszközt akarunk létrehozni, amely a transzlációt segíti a központi idegrendszerrel kapcsolatos gyógyszerkutatásokban. Mintegy másfél évtizede ugyanis egyfajta innovációs válsággal küzd ez a terület: egyebek mellett a demenciára, az Alzheimer-betegségre, az autizmusra nincsenek hatékony új gyógyszerek” – tájékoztatta magazinunkat a kutatócsoportot vezető Gyertyán István.

A szakember több évtizedes gyógyszeripari kutatótevékenysége során szembesült azzal, hogy a tanulást segítő, azt fokozó, ígéretes gyógyszercélpontként felmerülő új alapkutatási eredményekre alapozva jelentős fejlesztéseket finanszíroznak a gyógyszergyárak, de erőfeszítéseik ellenére az új gyógyszerjelöltek sorra elbuknak. Több száz ilyen lehetséges célpontot tártak fel világszerte a kutatók, ehhez képest mindössze kettőt hasznosítanak – ráadásul ezek hatékonysága sem túl meggyőző. A kudarcok hatására sok gyógyszergyár úgy döntött, nem áldoz újabb dollármilliárdokat a központi idegrendszer betegségeinek kutatására. Miközben harminc-negyven év múlva a társadalom negyedét demencia és Alzheimer-kór miatt kezelni kell.
Mi áll a kudarcok hátterében? A magyar kutatók szerint valószínűleg az, hogy az alapkutatási állatkísérletek során használt tanulási paradigmák nem megfelelőek a különböző betegségekben defektes humán kognitív folyamatok modellezésére. Előbbiekben az állatok tanulási folyamatait kutatjuk, feltárjuk, hogy egy adott feladat során mely agyterületek milyen sejtjei aktiválódtak. Ám ezek még nem azok az eredmények, amelyekre a gyógyszergyáraknak szükségük van. Utóbbiak ígéretes célpontokat várnak, hogy arra fejleszthessenek molekulákat, amelyek egyikéből évek múlva gyógyszer lehet. A felkínált célpontok azonban eddig nem jöttek be.
A potenciális célpontokat tehát valamilyen módszer alapján szűrni, értékelni kell. Meg kell állapítani, hogy ezek valóban jók-e arra, hogy egy adott betegséget ezeken keresztül támadva gyógyítsanak meg. Gyertyán István és munkatársai egy olyan modellrendszer felállítására vállalkoztak patkányokon (és terveik szerint egereken is), amely a gyógyszerfejlesztés hatékonyságának növelését ígéri. Meggyőződésük, hogy egy potenciális célpont használhatóságát nem egy, hanem több tanulási feladat alapján lehet csak feltérképezni.
 Albínó patkány az ötválasztásos reakcióidő tesztben. Az öt lyuk egyikében 1 másodpercre felvillan a fény, amit az állatnak 3 másodpercen belül az adott lyukba való orrbedugással kell „nyugtáznia” ahhoz, hogy jutalmat kapjon. A módszerrel az állatok figyelme, illetve impulzív viselkedése mérhető.
Albínó patkány az ötválasztásos reakcióidő tesztben. Az öt lyuk egyikében 1 másodpercre felvillan a fény, amit az állatnak 3 másodpercen belül az adott lyukba való orrbedugással kell „nyugtáznia” ahhoz, hogy jutalmat kapjon. A módszerrel az állatok figyelme, illetve impulzív viselkedése mérhető.„Az elromlott humán tanulási folyamat modellezésére valamilyen módon el kell rontani az állatok tanulási képességeit. Sokféle út ismert, de egyikre sem mondható, hogy az az egyedül célravezető. A mi tesztrendszerünknek az a lényege, hogy az állatok többféle tanulási feladatot sajátítanak el, majd különböző módon megpróbáljuk lerontani a tanulási teljesítményüket” – magyarázta Gyertyán István. A lerontás történhet különböző vegyületek adagolásával, feladatok nehezítésével, stresszes környezet teremtésével, használhatják az eleve gyengébb teljesítményű állatokat, illetve öreg patkányokat is vizsgálhatnak. A potenciális célpontok esetében megnézik, hogy a különböző kognitív funkcióknál a különböző rontások esetén mi történik. Mintázatot kapnak, ami az eddigi kísérletekben azt mutatta, hogy nem minden kognitív funkció esetében érnek el kedvező hatást, nem minden rontással szemben lesz hatékony az adott célpont. Ez azért jó, mert a különböző betegségekben is eltérően károsodnak a különböző kognitív funkciók – az Alzheimer-betegek el szoktak tévedni, az autisták mások érzelmi jeleit kódolják nehezen.
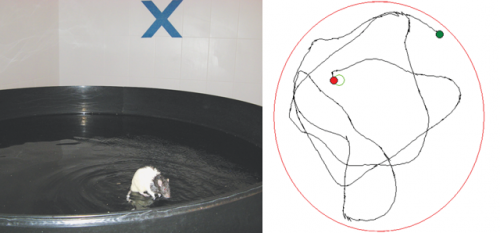 Tájékozódási feladat vízi útvesztőben. A csuklyás patkányok egy a felszín alatt elhelyezkedő padkára tudnak kimenekülni a vízből, azt azonban közvetlenül nem látják, hanem a medencén kívül észlelhető fix viszonyítási pontok alapján kell lokalizálniuk. A rajz egy sikeres kitalálás útvonalát mutatja (a zöld pont a vízbe tevés, a zöld kör a padka helyét, a piros pont az úszás végpontját jelöli).
Tájékozódási feladat vízi útvesztőben. A csuklyás patkányok egy a felszín alatt elhelyezkedő padkára tudnak kimenekülni a vízből, azt azonban közvetlenül nem látják, hanem a medencén kívül észlelhető fix viszonyítási pontok alapján kell lokalizálniuk. A rajz egy sikeres kitalálás útvonalát mutatja (a zöld pont a vízbe tevés, a zöld kör a padka helyét, a piros pont az úszás végpontját jelöli).„Mi azt mondjuk: akkor ígéretes egy célpont, ha minél több rontással szemben hatékony. Emellett meg kell keresni azt a betegséget, amelynek a defektes mintázata a legközelebb áll a javító mintázathoz, és annál a betegségnél érdemes az adott mechanizmust kipróbálni. Ennek a rendszernek a kidolgozását vállaltuk” – summáz a kutató. Gyertyán Istvánék munkájának célja a találati valószínűség jelentős növelése. Eddig sokba került, ha a klinikai kísérletek során derült ki, hogy mégsem volt megfelelő a célpont. A kutatócsoport a vélelmezett hatékonyság valószínűségét megerősíti vagy éppen csökkenti.
 A „cserépugrás” nevezetű teszt az úgynevezett procedurális (mozgási) tanulás és memória vizsgálatára alkalmas. Az állatok egymástól egyre nagyobb távolságra elhelyezett cserepekre átugrálva deríthetik fel környezetüket.
A „cserépugrás” nevezetű teszt az úgynevezett procedurális (mozgási) tanulás és memória vizsgálatára alkalmas. Az állatok egymástól egyre nagyobb távolságra elhelyezett cserepekre átugrálva deríthetik fel környezetüket.A munka nem volt egyszerű. Abban a hitben nehezítettek például egyes teszteken, hogy a kontrollcsoport kísérleti állatai többször tévesztenek majd, mint a hatóanyaggal kezeltek, ezzel szemben több kezeletlen patkány számára nem jelentett gondot a változás. Más tesztekben a tanulási folyamatot javító szer nem működött. Egyébként a negatív eredmény is eredmény, amit ugyancsak közölni kell, mert így mások nem szaladnak bele ugyanabba a zsákutcába. Ezek legalább olyan értékes adatok, mint amikor az derül ki valamiről, hogy működik.
 Kísérleti alany az „új tárgy felismerés” tesztben. A két megszemlélhető tárgy közül az egyiket már látta bizonyos idővel ezelőtt az állat, a másik új számára, így azt hosszasabban vizsgálja. Ha azonban az állat nem emlékszik az ismert tárgyra, úgy az újjal közel azonos ideig nézegeti és szimatolgatja.
Kísérleti alany az „új tárgy felismerés” tesztben. A két megszemlélhető tárgy közül az egyiket már látta bizonyos idővel ezelőtt az állat, a másik új számára, így azt hosszasabban vizsgálja. Ha azonban az állat nem emlékszik az ismert tárgyra, úgy az újjal közel azonos ideig nézegeti és szimatolgatja.„Szűrni, vizsgálni kell az újonnan felbukkanó hatásmechanizmusokat. Mi eddig hármat vizsgáltunk, de többen többet elvégezhetnénk. Az lenne az ideális, ha – a klinikai gyógyszerkipróbáláshoz hasonlóan – multicentrikus vizsgálatokra kerülhetne sor. Ami mindenütt működik, az esélyes célpont lehet. Ilyet még mi sem találtunk. Azonban ami megbukott a klinikán, az nálunk is elvérzett. Ez az út járható és követendő” – üzeni Gyertyán István.
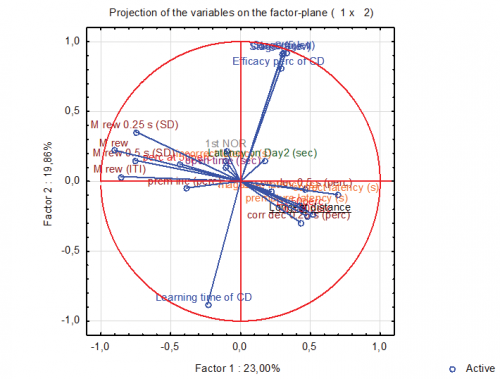 Különböző tanulási tesztekben mért teljesítményváltozókon elvégzett főkomponens analízis eredménye. Az elemzés „csokorba szedi” az azonos kognitív képességeket tükröző tanulási paramétereket.
Különböző tanulási tesztekben mért teljesítményváltozókon elvégzett főkomponens analízis eredménye. Az elemzés „csokorba szedi” az azonos kognitív képességeket tükröző tanulási paramétereket.Kísérleti állataik első csoportja megöregedett, két és fél évesek, harminc még él az eredeti 36-os populációból – miközben a patkányok általában kétéves korukig élnek. A matuzsálemi kort minimum két okkal magyarázzák. A korlátozott táplálékbevitel miatt nem híznak el a rágcsálók. A másik, hogy aktív életük volt: hetente járatták az agyukat. A humán adatok is azt bizonyítják, hogy az Alzheimer-kór elleni leghatásosabb védelem a folyamatos kognitív teljesítmény, az agy intenzív használata. Gyertyán István szerint az ilyen patkányok esetében nem könnyű lerontani a kognitív képességeket, még idősen is meglepően jól teljesítenek. Ha mégis sikerül, akkor viszont nem könnyű visszatérni a rontás előtti szintre. Ez jól tükrözi a humán viszonyokat: ha az emberben valami elromlik, annak nagyon súlyos dolognak kell lennie, hiszen általában nincs visszaút.•
2017. augusztus