Fájdalomcsillapítás génszerkesztéssel?
 A munkacsoport tagjai (balról): Nánásiné Molnár Tímea Krisztina, Szücs Péter, Kókai Éva, Varga Angelika, Mészár Zoltán.
A munkacsoport tagjai (balról): Nánásiné Molnár Tímea Krisztina, Szücs Péter, Kókai Éva, Varga Angelika, Mészár Zoltán.A fájdalom enyhítése az orvostudomány egyik fő feladata. Mivel tud ehhez hozzájárulni az olyan alapkutatás, mint az önöké?
Szücs Péter: A mi szakterületünk a gerincvelő, amely a fájdalomfeldolgozás elsődleges állomása. Nem kérdés tehát, hogy minden információ, ami közelebb visz bennünket e rendszer megértéséhez, közelebb visz a fájdalomcsillapítás eszköztárának bővítéséhez, illetve olyan típusú fájdalmak enyhítéséhez, amelyekhez jelenleg nem állnak rendelkezésre hatékony módszerek. Tudjuk például, hogy a gerincvelő hátsó szarvában helyezkednek el azok az idegsejtek, amelyek a test felszínéről (a perifériáról) érkező fájdalmas és ártalmatlan stimulusokat, valamint az agy különböző központjaitól érkező úgynevezett leszálló serkentő/gátló parancsokat integrálják, így meghatározó szerepük van a fájdalomérzet kialakulásának szabályozásában. Arról viszont, hogy a fájdalmas ingerek feldolgozása milyen molekuláris mechanizmusok által szabályozódik, még mindig elégtelen információ áll rendelkezésre. A Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal FK_125035 pályázata, valamint a NAP2 program keretében a munkacsoportunk éppen ezért tűzte ki célul a gerincvelői neuronhálózatok szerveződésének molekuláris szintű megismerését, illetve a gerincvelői szinten megvalósuló fájdalommoduláció megértését. Eredményeink hozzájárulnak azoknak a neuro-epigenetikai szabályozó és finomhangoló mechanizmusoknak a megértéséhez, melyek a szöveti sérülés által előidézett idegi aktivitásfokozódáshoz, majd következményes fokozott fájdalomérzethez vezetnek, és ezzel közelebb vihetnek egy olyan terápia kidolgozásához, amivel az égési sérülés miatt kórosan csökkent fájdalomküszöböt (az úgynevezett hő-hiperalgéziát) a normális közelébe emelve lehetne enyhíteni a beteg fájdalmait.
Újfajta biotechnológiai megközelítésünk pedig egyéb neurológiai kórképek célzott vizsgálatában is hasznos lehet.
Hogyan kerültek képbe kutatásaik során a hisztonfehérjék, illetve a dinorfinerg neuronok?
Varga Angelika: A londoni Imperial College-ban dolgozó dr. Nagy István vezetésével végzett kollaborációs kutatások alapján azt már kísérleteink beállítása előtt is tudtuk, hogy a gerincvelő hátsó szarvi neuronjaiban a hiszton H3 foszforilációja az Erk-MSK1/2 útvonalon keresztül valósul meg nociceptív stimulus hatására, mely jelátviteli kaszkád végül a viselkedés szintjén hő-hiperalgéziát eredményez. Megfigyeltük azt is, hogy a hiszton H3 foszforilációját végző útvonalak blokkolásával – a foszforilációért felelős MSK1/2 enzim enzimatikus vagy genetikai blokkolásával – a kísérleti állatok fájdalomérzete megváltoztatható. Azt viszont, hogy ebben a folyamatban melyik hátsó szarvi idegsejtcsoportok vesznek részt, ekkor még nem tudtuk. Az első lépés tehát ezeknek a neuroncsoportoknak az azonosítása volt. Azt találtuk, hogy a dinorfinerg idegsejtek azok, amelyek leginkább érintettek ebben a folyamatban, ezért innentől kezdve erre a neuroncsoportra koncentráltunk.
A dinorfinerg sejtek azonosítása után hogyan jött képbe a géneditáció?
Szücs Péter: A jelenlegi NAP-pályázat kezdetén az idegsejtek működéséért felelős ioncsatornák genetikai módosításával is kívántunk foglalkozni. Az erre való technikai előkészületek során akadt a kezünkbe egy japán szerzők által jegyzett közlemény, amely kiindulási pontként szolgált a géneditálási stratégiánk kidolgozásához. Célunk az volt, hogy kizárólag a gerincvelői dinorfinerg idegsejtekben idézzünk elő pontmutációt a hiszton H3-ban, hogy ne történhessen meg a foszforiláció az adott aminosavon (szerin 10). Mivel a H3 foszforilációja egyébként a sejtosztódáskor is esszenciális folyamat, a minden testi sejtet érintő hiszton H3 manipuláció katasztrofális következményekkel járna, emiatt tehát nem volt járható út számunkra például a konvencionális knockout megközelítés.
Milyen elven működik az önök által kifejlesztett pontmutációs eljárás?
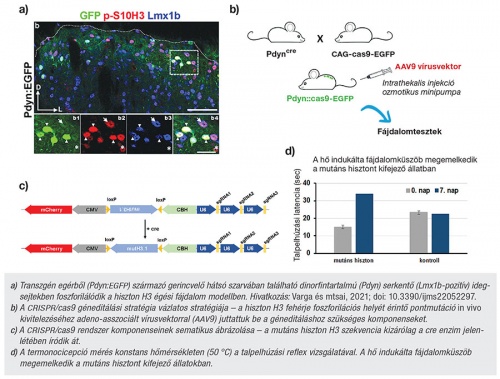
Mészár Zoltán: Technikánk virális transzfer eljáráson alapul (hasonlóan egyes COVID–19 elleni vakcinákhoz), vagyis a sejtekbe vírus segítségével juttatunk be idegen DNS-t. Az általunk megalkotott vírusvektor a CRISPR/cas9 géneditálási technika alkotóelemeit kódoló génszakaszokat tartalmazza. Az alkalmazott nem patogén vírus idegsejteket fertőz ugyan, de nem replikálódik a sejten belül, és betegséget sem okoz. Ráadásul a rendszer elemeit úgy hangoltuk, hogy azok kizárólag a gerincvelői dinorfinerg sejtekben működjenek.
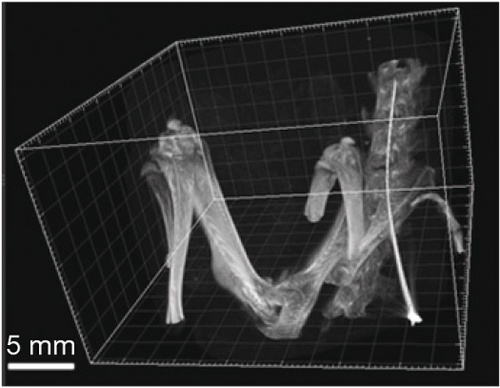 A vírus bejuttatására szolgáló ún. intratékális kanül lokalizációjának ellenőrzése mikro-CT-vel. A vírust ily módon közvetlenül a gerincfolyadékba juttatja be egy, a kanülhöz rögzített ozmotikus minipumpa.
A vírus bejuttatására szolgáló ún. intratékális kanül lokalizációjának ellenőrzése mikro-CT-vel. A vírust ily módon közvetlenül a gerincfolyadékba juttatja be egy, a kanülhöz rögzített ozmotikus minipumpa.Az új technika kidolgozását természetesen in silico kezdtük, vagyis először számítógépen szerkesztettünk egy olyan DNS-szekvenciát, amely a vad típusú hisztonfehérjét kiiktatja az idegsejtekből, és ezzel egy időben a pontmutált hisztonfehérje kifejeződését biztosítja. Ezt a mesterséges DNS-szakaszt aztán beépítettük a már említett vírustörzsbe. E beavatkozást követően a célba vett dinorfinerg sejtekben már kizárólag csak ez a mutáns hisztonfehérje fejeződik ki, a sejtek már csak ezt a fehérjét tudják a további fiziológiai folyamataikhoz felhasználni.
 Megbeszélés a konfokális felvételről (balról): Mészár Zoltán, Varga Angelika, Szücs Péter.
Megbeszélés a konfokális felvételről (balról): Mészár Zoltán, Varga Angelika, Szücs Péter.Kísérleteink alapján egyébként úgy tűnik, hogy ez a biotechnológiai stratégia alkalmas lesz arra, hogy ennek segítségével szétválogassuk az idegsejtek párhuzamos feladatait. Képesek legyünk továbbá ezeket a feladatokat szelektíven vizsgálni, hogy ezeket a funkciókat külön-külön tudjuk blokkolni vagy serkenteni. Mint ilyen, a karmester szerepét játszó hisztonkód jobb megértéséhez, megfejtéséhez lehet kulcs, vagyis reményeink szerint más kutatók számára is hasznos eszköz lehet a jövőben.•
A publikációban szereplő kutatást az Innovációs és Technológiai Minisztérium (2017-1.2.1-NKP-2017-00002), valamint a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal (NKFIH, FK-125035) támogatja.