Peptiddel támadják a rákos sejteket

A rák gyógyítására alkalmazott kemoterápia hátránya, hogy az alkalmazott gyógyszerek nem specifikusak, azaz bizonyos egészséges sejtekre is hatnak. Ebből származnak olyan kellemetlen mellékhatások, mint a hajhullás, az étvágytalanság, a hányás vagy a fertőzésekre való fokozott érzékenység. Ezeket azért lenne jó elkerülni, hogy a kezelések idején a betegek életminősége ne romoljon. A problémán úgy igyekeznek segíteni, hogy célzottan juttatják a hatóanyagokat a ráksejtekbe, amit kétféle módon érhetnek el. Az egyik: a hatóanyagokat tumorspecifikus ellenanyagokhoz (antitestekhez) kapcsolják, ám ez esetben komoly korlátozó tényező, hogy a hordozó molekulára kevés számú vegyület kapcsolható. Másik hátrány – a magas előállítási költség mellett –, hogy az ellenanyag-drog konjugátumok meglehetősen nehezen jutnak a tumorszövetek belsejébe. E szempontok miatt kezdtek el foglalkozni a kutatók egy új módszerrel: kis molekulákhoz kapcsolják a hatóanyagot. Ezek lehetnek szerves molekulák, például a folsav, amelynek a receptora nagy mennyiségben megtalálható a tumorsejteken. Egyes peptidreceptorok szintén nagy számban előfordulnak a kóros sejteken, amelyek az egészségeseken nincsenek, vagy sokkal kevesebb van belőlük. „Ha a receptorokat felismerő peptidhez kapcsoljuk a hatóanyagot, akkor a gyógyszer az egészséges sejtekkel szemben sokkal nagyobb arányban juthat be a ráksejtekbe. Mi ilyen konstrukciók kidolgozásán munkálkodunk. Különböző hatóanyagokat tumorspecifikus peptidekhez kapcsoltunk, majd vizsgáltuk tumorellenes hatásukat” – tájékoztatott Mező Gábor.
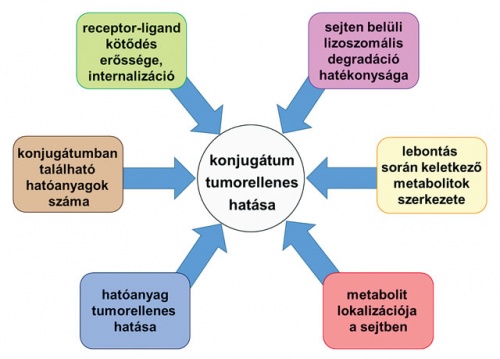 A célzott terápiára alkalmas konjugátumok hatékonyságát befolyásoló tényezők, amelyeket a tervezés során figyelembe kell venni.
A célzott terápiára alkalmas konjugátumok hatékonyságát befolyásoló tényezők, amelyeket a tervezés során figyelembe kell venni.A Nemzeti Kutatási, Fejlesztési és Innovációs Alapból támogatott Nemzeti Versenyképességi és Kiválósági Program (NVKP) keretében egyebek mellett olyan pályázatok kaptak támogatást, melyek célja a kiemelkedő halálozási kockázattal járó betegségek gyógyítási eredményességének jelentős javítása. Az ilyen irányú kutatásokat mintegy tíz évvel ezelőtt elkezdő csoport munkájának nagy lökést adott a 2016-os NVKP-pályázaton (NVKP_ 16-1-2016-0036) nyert egymilliárd forint. Az akkor alakult konzorciumnak – melyet Mező Gábor vezet – tagja lett az Eötvös Loránd Tudományegyetem (ELTE) Kémiai Intézete Csámpai Antal vezetésével és az ott működő MTA–ELTE Peptidkémiai Kutatócsoport, a Semmelweis Egyetem Genetikai, Sejt- és Immunbiológiai Intézete Kőhidai László vezetésével, valamint a ComInnex Kutatás-Fejlesztési Zrt. Bertók Béla vezetésével. A konzorcium arra vállalkozott, hogy három olyan vegyülettárat állít elő (1. tumorellenes hatóanyagok; 2. irányítómolekulák [ezek a peptidek]; 3. az előző kettőt összekapcsoló bifunkciós linkerek), amelyek nagy variabilitással kapcsolhatók egymáshoz, így akár száz különböző gyógyszerjelölt molekulát is létrehozhatnak. Ezek a gyógyszerjelöltek alkalmasak lehetnek a magas mortalitású tumorok hatékony, személyre szabott, célzott terápiájára.
„Nagyon fontos volt annak feltérképezése, hogy a hatóanyagokat és a peptideket hogyan tudják úgy összekapcsolni, hogy stabilak maradjanak a véráramban, de a tumorsejtbe jutva a hatóanyag felszabaduljon. Az összekapcsolást végző úgynevezett linkerek megtalálása külön kutatási vonal volt” – érzékeltette Mező Gábor a megoldandó feladatokat. A fejlesztés során ígéretesnek tűnő vegyületkomplexek tumorellenes hatását az Országos Onkológiai Intézet Kísérletes Farmakológiai Osztályán Tóvári József csoportja vizsgálta egerekben.
A konzorcium tagjai 5-20 aminosavból álló peptidekre koncentráltak, ezekre egy-kettő-három hatóanyag kapcsolható. Legújabb eredményeik azt mutatják, hogy nem feltétlenül az a jó út, ha a hordozókat telepakolják hatóanyagokkal – a sok vegyület ugyanis gátolhatja a konjugátum receptorfelismerését, és így a sejtbe jutását is. Azt is megállapították, hogy a kapcsolt hatóanyagok elhelyezkedése is fontos a peptideken, mert szintén befolyásolhatják a receptorfelismerő képességet, illetve az aktív hatóanyag felszabadulását. Komoly kihívás volt a legjobb és leghatékonyabb szerkezet megtalálása.
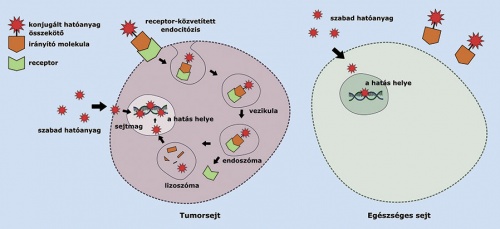 A célzott tumorterápia előnye: a tumorsejteken megjelenő specifikus receptorok biztosítják, hogy az irányító peptidhez kapcsolt hatóanyag csak a tumorsejtekbe jusson be. Ezzel szemben a szabad hatóanyag az egészséges sejtekbe is bejuthat.
A célzott tumorterápia előnye: a tumorsejteken megjelenő specifikus receptorok biztosítják, hogy az irányító peptidhez kapcsolt hatóanyag csak a tumorsejtekbe jusson be. Ezzel szemben a szabad hatóanyag az egészséges sejtekbe is bejuthat.A kutatócsoport elmúlt évtizedben végzett kutatásai (beleértve a június végén záruló NVKP-programot) jelentős nemzetközi figyelmet kaptak. Külföldi kutatók érdeklődését felkeltve közösen indultak európai uniós pályázaton. A magyarok mellett két-két olasz és német, illetve egy finn egyetem részvételével, valamint neves gyógyszergyártók – mint a Bayer, a Heidelberg Pharma és az Italfarmaco – összefogásával született konzorcium sikerrel pályázott a Horizon 2020 Maria Curie-Skłodowska ITN kiíráson. Tavaly az Európai Unió illetékes testülete újabb négyéves, 2023-ig szóló támogatással ismerte el a 2015–2018 között végzett munkát. Nagyon ritkán hosszabbítanak meg lejárt pályázatot, ám most ez történt. A kutatás minőségét jelzi, hogy a korábbi partnerek mellé csatlakozott a világ legjobb felsőoktatási intézményei között emlegetett ETH Zürich is.
Miben mérhető a sikeresség? Mező Gábor szerint például abban, hogy a számos publikáció mellett a konzorcium által felfedezett több hatóanyag is szabadalmaztatás alatt áll. „Reméljük a sikert, eredményünk több mint biztató, hiszen a nanorészecskébe csomagolt egyik vegyületünkkel kezelt állatokban eltűnt a tumor. Ezt a meglehetősen instabil hatóanyagot szeretnénk peptidekhez kapcsolni, de a szerkezete egyelőre nem teszi lehetővé a megfelelő kötés kialakítását közte és a peptid között. Lehetséges megoldásként a peptideket beépítenénk a nanorészecskékbe – például liposzómákba. Ha sikerül, akkor a peptidek a nanorészecske egészének irányításával segítenék a hatóanyag célba juttatását” – foglalta össze a feladatokat a kutató, aki szerint a Semmelweis Egyetemmel folytatódik a munka. Most benyújtandó közös OTKA-pályázatuk arra fókuszál, hogy ne csak a tumorsejteket támadhassák ezzel a módszerrel, hanem az úgynevezett tumor őssejteket is. A rákos betegség kiújulásáért ugyanis főleg ezek felelősek. Amíg ezeknek a sejteknek az elpusztítása megoldatlan, a rákterápia átmeneti megoldás.
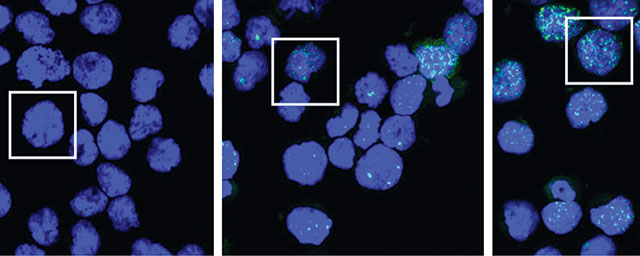
 A konjugátumként tumorsejtbe juttatott hatóanyag útjának követése konfokális mikroszkóp segítségével. A konjugátum a receptorkötődés után endocitózissal a tumorsejtekbe jut, ahol a lizoszómákban lebomlik (a képen 1-10 perc), majd az aktív származék a sejtmagba jutva fejti ki a hatását (a képen 30 perc).
A konjugátumként tumorsejtbe juttatott hatóanyag útjának követése konfokális mikroszkóp segítségével. A konjugátum a receptorkötődés után endocitózissal a tumorsejtekbe jut, ahol a lizoszómákban lebomlik (a képen 1-10 perc), majd az aktív származék a sejtmagba jutva fejti ki a hatását (a képen 30 perc).A konzorcium vezetője azt reméli, hogy a közeljövőben a NVKP-hoz hasonló volumenű pályázatot írnak ki, amelyen, ha sikerrel szerepelnek, a korábbi konzorciumi tagok bevonásával folytatható a munka. Az igazi áttörést az jelentené, ha nem is mindegyik vegyületükből, de egy-kettőből gyógyszer lesz.•