Három irányban kutatnak a szegedi nemzeti laboratóriumban
 A Biotechnológiai Nemzeti Laboratórium vezető kutatói. Balról jobbra: Mihály József, a Genetikai Intézet tudományos tanácsadója, Erdélyi Miklós, a Genetikai Intézet igazgatója, Nagy Ferenc, az SZBK főigazgatója, Pál Csaba, a Biokémiai Intézet tudományos tanácsadója és Kintses Bálint, a Biokémiai Intézet tudományos főmunkatársa. (Fotó: Karnok Csaba)
A Biotechnológiai Nemzeti Laboratórium vezető kutatói. Balról jobbra: Mihály József, a Genetikai Intézet tudományos tanácsadója, Erdélyi Miklós, a Genetikai Intézet igazgatója, Nagy Ferenc, az SZBK főigazgatója, Pál Csaba, a Biokémiai Intézet tudományos tanácsadója és Kintses Bálint, a Biokémiai Intézet tudományos főmunkatársa. (Fotó: Karnok Csaba)„Az egészségügy egyre gyakrabban felmerülő problémája az antibiotikumnak ellenálló kórokozók elszaporodása. Az antibiotikumok gyakori és sokszor indokolatlan használata ugyanis hozzájárult olyan baktériumtörzsek térhódításához, amelyekkel szemben a jelenlegi kezelési módszerek lassan hatástalanná válnak. A lélegeztetőgépre kerülő koronavírusos betegek jelentős részének – mintegy egynegyedének – ilyen kórokozók okozta felülfertőződés is hozzájárul a halálához. Ha nem fejlesztenek ki az ilyen, úgynevezett szuperbaktériumokkal szemben hatékony vegyületeket, akkor a WHO előrejelzése alapján 2050-re e kórokozók okozta megbetegedések szedik a legtöbb áldozatot. A multidrogrezisztens baktériumok a rákos megbetegedéseket is megelőzhetik a vezető halálokok listáján” – tájékoztatott Kintses Bálint, az SZBK tudományos főmunkatársa, egyúttal arra is választ adva, hogy a Biotechnológiai Nemzeti Laboratórium egyik fő csapásiránya miért a multidrogrezisztens baktériumok elleni küzdelem lett. Pál Csaba, Papp Balázs és Kintses Bálint irányításával a kutatócsoportok újfajta antibiotikumok tervezésével, valamint bakteriofágalapú terápiás eljárások kidolgozásával veszik fel a harcot a kórokozók ellen.
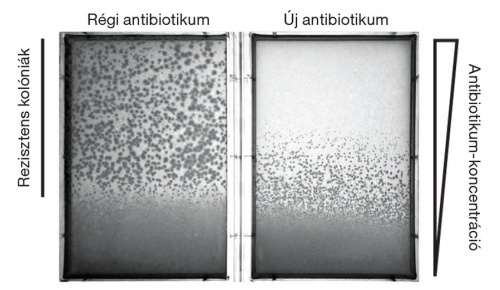 A táplemezek, alulról felfelé haladva, növekvő koncentrációban tartalmazzák az antibiotikumokat. Mindkét lemez teljes felületére baktériumkultúrát helyezünk. Növesztés után a vizsgált baktériumtörzs a régi antibiotikum legmagasabb dózisa mellett is képes nőni és kolóniákat formálni. Ezzel szemben az új antibiotikumot alkalmazva a baktériumtörzs egy bizonyos dózis után már nem életképes.
A táplemezek, alulról felfelé haladva, növekvő koncentrációban tartalmazzák az antibiotikumokat. Mindkét lemez teljes felületére baktériumkultúrát helyezünk. Növesztés után a vizsgált baktériumtörzs a régi antibiotikum legmagasabb dózisa mellett is képes nőni és kolóniákat formálni. Ezzel szemben az új antibiotikumot alkalmazva a baktériumtörzs egy bizonyos dózis után már nem életképes.„Az elmúlt években olyan hasonló szerkezetű molekulákkal foglalkoztam, amelyek más-más szuperbaktérium ellen voltak hasznosak. Az első két molekula hatékonynak tűnt laboratóriumi körülmények között az MRSA-fertőzéssel szemben. Ezt a methicillin-rezisztens Staphylococcus aureus baktérium, röviden MRSA okozza, amely az egyik legveszélyesebb kórokozó Európában, így Magyarországon is. Vannak országok, ahol több fertőzést, illetve gyakran halálos kimenetelű megbetegedést okoz, mint a többi fertőző betegség együttvéve. A molekuláink gyakorlati alkalmazása azonban még távol van – például túl nagy dózisban kellene alkalmazni –, ezért szabjuk-varrjuk ezeket, hogy a számunkra kedvező tulajdonságai javuljanak. A program ezt a munkát teszi lehetővé” – mondta Pál Csaba tudományos tanácsadó, aki akkor lesz elégedett, ha preklinikai fázisig eljutva értekesíteni tudják a hatóanyagot.
„2017-ben döntöttük el, hogy nemcsak a publikálást tartjuk fontosnak, hanem felfedezéseink iparjogvédelmét és hasznosítását is. Azt találtuk ki, hogy a találmányokat nem cégekbe szervezzük ki, hanem az intézethálózat keretein belül hasznosítjuk. Büszkék vagyunk arra, hogy egyik találmányunkat önerőből sikerült értékesíteni a nemzetközi piacon” – mondta el Kintses Bálint.
 Baktériumok robotizált vizsgálata antibiotikum-rezisztencia kutatásához.
Baktériumok robotizált vizsgálata antibiotikum-rezisztencia kutatásához.A rezisztens baktériumok mellett egyéb súlyos fertőző betegségek is komoly problémákat okoznak. A különböző járványokért felelős kórokozók könnyebben és gyorsabban jelennek meg a világ különböző pontjain. A fertőzések ilyen fokú terjedésével szemben a hagyományos oltóanyagok előállítása és tesztelése nem tud lépést tartani. Az mRNS-en alapuló új eljárásnak azonban olyan előnyös tulajdonságai vannak, hogy biztonságosabb, gyorsabb és olcsóbb vakcinálás válik lehetővé.
„A fehérjék előállításához szükséges információ a DNS-ről egy közvetítő molekula, az mRNS segítségével jut el a fehérjeszintézis helyszínére. Az mRNS felfedezése óta foglalkoztatja a kutatókat, hogyan lehetne mRNS-molekulák bejuttatásával fehérjeszintézisre bírni a sejteket. A korai kísérletek szerint a bevitt mRNS-ek gyorsan elbomlottak, és nem kívánt immunreakciókat váltottak ki. Karikó Katalinnak, az SZBK egykori kutatójának a Pennsylvaniai Egyetemen folytatott kísérleteiből tudjuk, hogy az mRNS-molekulák egyik építőkövének alkalmas megváltoztatásával a nem kívánt immunreakciók elkerülhetők. A kutatónő munkásságának köszönhetően egy új világ, az mRNS-alapú biotechnológiai módszertan született meg” – mondta el Erdélyi Miklós, a Genetikai Intézet igazgatója. Az mRNS-alapú eljárások biztonságosak, mert nem változtatják meg a sejtek örökítőanyagát. A módszer gyors fejlesztőmunkát tesz lehetővé, és számos felhasználási lehetősége van, melyek közül kiemelkedik a vakcináció. Hazánkban az mRNS-alapú technológiát Szegeden szeretnék elsőként meghonosítani. Ebben a munkában Karikó Katalin tanítványa, a szintén Szegeden végzett Pardi Norbert lesz a segítségükre, aki felfedezte, hogy a Karikó-féle eljárás miként használható immunizálásra. A Tisza-parti városban jön létre az első olyan magyarországi kutatóhely, ahol az mRNS-alapú kísérleti vakcina-előállítás minden egyes technológiai lépése megvalósítható. „Kiemelt célunk a hazánkban jelentős gazdasági károkat okozó afrikai sertéspestis elleni vakcina létrehozása. A kórokozó ellen jelenleg nincs hatékony oltóanyag. Mi abban hiszünk, hogy a Karikó–Pardi-féle technológia megoldást jelenthet” – vázolta a jövőt Erdélyi Miklós.
A Biotechnológiai Nemzeti Laboratórium harmadik fő célkitűzése, hogy engedélyezett gyógyszerek szűrésével olyan hatóanyagokat találjanak, amelyek alkalmazhatók lehetnek ritka, monogénes betegségek kezelésére. „A ritka betegségek kifejezés gyűjtőnév. Azok a betegségek tartoznak ebbe a körbe, amelyek tízezerből legfeljebb öt, a szigorúbb definíció szerint pedig maximum két emberben fordulnak elő. Egy-egy ilyen betegség keveseket érint, ugyanakkor, mivel ma már nyolcezret ismerünk, összességében az emberek öt százaléka, azaz 400 millió ember érintett. A ritka betegségek fele vagy már születéskor, vagy gyerekkorban megjelenik” – vázolta a jelenlegi helyzetet Mihály József, az SZBK Genetikai Intézetének tudományos tanácsadója. Napjainkban a ritka betegségek kevesebb mint öt százalékára létezik gyógymód – a nagy gyógyszergyárak az alacsony betegszám miatt nem erőltetik az ilyen kutatásokat, hiszen a várható haszon limitált. Ráadásul az elérhető terápia ezeknek az eseteknek a többségében csak tüneti kezelést jelent, így ezen a téren óriási az adósság.
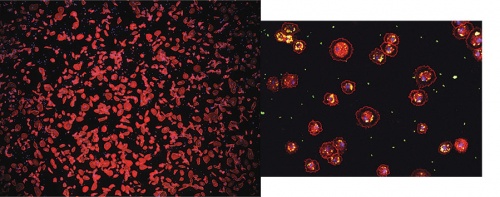 JAK kináz aktivációhoz köthető vérsejt proliferáció/tumor képződés Drosophilában.
JAK kináz aktivációhoz köthető vérsejt proliferáció/tumor képződés Drosophilában.Az utóbbi 10-15 évben egyre elterjedtebb az ismert gyógyszerek újrahasznosítása, újrapozicionálása. A szakemberek több esetben felismerték, hogy bizonyos hatóanyagok az eredeti alkalmazási javaslattól eltérő betegségek kezelésére is alkalmasak lehetnek. Klasszikus példa erre a kék pirulaként is emlegetett potencianövelő, amelyet eredetileg a magas vérnyomás kezelésére fejlesztettek ki. A klinikai kísérletek során derült ki, hogy ugyan az eredeti célra nem hatékony a vegyület, de a nem várt mellékhatás – azaz a potencianövelés – óriási üzleti bevételt hozott később a gyártónak. Bő évtizede tudatosan kutatják a forgalmazott gyógyszerek esetleges jótékony, addig nem ismert mellékhatásait – ha bejön, sokkal gyorsabban és költséghatékonyabban kezelhetnek betegeket. Egy új gyógyszer kifejlesztése ugyanis a hagyományos módon 13-15 évig tart, és két-három milliárd dollár, azaz 600-900 milliárd forint költséggel jár. (A Richter Gedeon Nyrt. tavalyi teljes árbevétele közel 510 milliárd forint volt.) „Mi kísérletes megközelítéssel, in vivo modellekkel keressük a meglévő hatóanyagok lehetséges újabb alkalmazási területeit. Erre a Drosophila melanogastert, azaz az ecetmuslicát használjuk. A Drosophila több mint száz éve alkalmazott kiváló modellállat emberi megbetegedések hátterének megismeréséhez, ugyanis az ecetmuslica genomjában megtalálható az emberi betegségekért felelős gének 70 százaléka. A Szegedi Tudományegyetem Gyermekgyógyászati Klinikájának szakembereivel 10-15 ritka betegség Drosophila modelljének létrehozása után két-háromezer engedélyezett gyógyszermolekulát tesztelünk, keresve az újabb alkalmazási lehetőségeket. Hosszú távon abban reménykedünk, hogy olyan molekulákat találunk, amelyeket a klinikai kísérleti engedélyezési fázisig el tudunk vinni e program keretében. Óriási eredmény lenne, ha szabadalommal védett termék lenne a munkánk eredménye” – bizakodik Mihály József.
„A program megálmodói előrelátó és nagy ívű elvárásokat fogalmaztak meg a laboratóriumokkal szemben. Elvárás volt, hogy beinduljon az innovációs lánc, keressünk partnereket, akikkel együtt valósítjuk meg céljainkat. Alapkutatástól a közvetlen termékfejlesztésig kutatjuk az új lehetőségeket. Három jól definiált programról van szó, amelyek egymást kiegészítik, erősítik, és megvalósításukban fontos szerepet játszanak a Szegedi Tudományegyetem és a HCEMM (Magyar Molekuláris Medicina Kiválósági Központ – a szerk.) kutatócsoportjai is. Az első két évre 1,7 milliárd forintot kaptunk, az öt évre összesen ötmilliárd forintot használhatunk fel, feltéve, ha az évenkénti beszámolók alapján a finanszírozó nívósnak ítéli az itt folyó kutatásokat. Olyan tudományos programokat indíthattunk el, amelyekre korábban forráshiány miatt nem volt lehetőség, amelyekről korábban csak álmodoztunk. Az öt év alatt eldől, hogy az eredeti koncepciónk életképes-e, vagy sem” – foglalta össze az elvárásokat és a reményeket Nagy Ferenc, a Szegedi Biológiai Kutatóközpont főigazgatója.
A kutatóközpontban új, 400 négyzetméteres épületszárnyat alakítanak ki, ahol biztonságos körülmények között, speciális infrastruktúrával foglalkozhatnak fertőző betegségek kórokozóival – az mRNS-vakcina, valamint a multidrogrezisztens baktériumok esetében ez alapvető.•